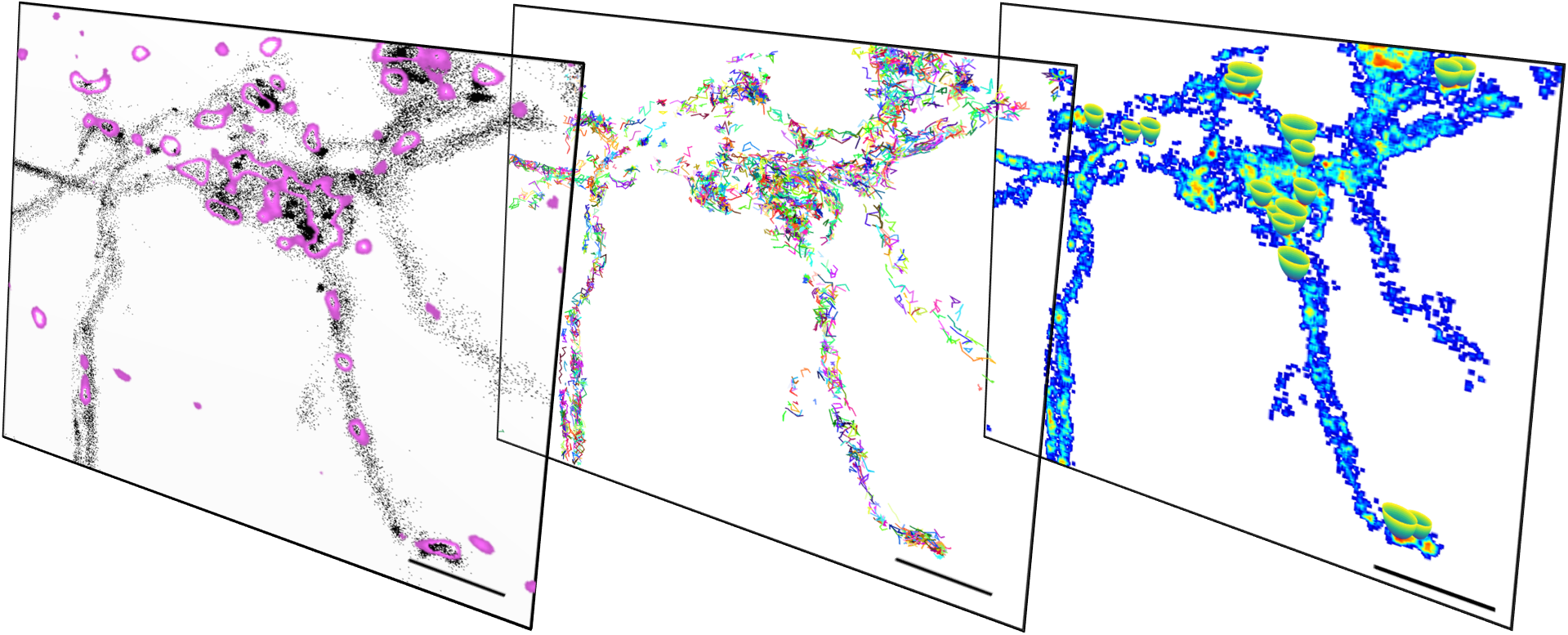
Lokalisation und Dynamik von spannungsabhängigen Kalziumkanälen im Axon von kultivierten hippocampalen Neuronen
links: Darstellung der Expression von mEOS3.2-getaggten CaV2.1 Kanälen als Einzelobjekte im Axon (grau). Synaptische Regionen sind in Magenta markiert.
mittig: Die Mobilität von Kalziumkanälen, gemessen in sptPALM Experimenten, wird durch die Bewegungsbahnen=Trajektorien einzelner Kanäle dargestellt.
rechts: Die Diffusionsmappe der CaV2.1 Kanäle, berechnet aus den Trajektorien, erlaubt schließlich die Identifizierung einzelne verdichtete Zonen, in welchen die Kanäle kurzzeitig stabilisiert werden, so genannte „energy wells“ (siehe Heck et al. 2019).
Die neuronale Kommunikation über chemische Synapsen wird durch die vesikuläre Freisetzung von Neurotransmittern initiiert - ein Prozess, der durch den vorübergehenden Einstrom von Kalziumionen (hauptsächlich durch spannungsabhängige Kalziumkanäle) ausgelöst wird.
Für die erfolgreiche Vesikelfusion und die damit verbundene Freisetzung von Neurotransmittern ist der Abstand zwischen präsynaptischen Kalziumkanälen und vesikulären Kalziumsensoren essentiell.
Daraus abgeleitet, entstand das Konzept von eng-gekoppelten Kalziumkanälen und synaptischen Vesikeln, die auf den Nanometer genau angeordnet sein müssen, um eine effiziente synaptische Freisetzung zu gewährleisten.
Allerdings handelt es sich bei der Synapse um ein hochdynamisches Kompartiment, in welchem die an der Neurotransmission beteiligten Moleküle ständig neu organisiert werden müssen.
Und auch der Aufbau der zellulären Membran als fluide Lipiddoppelschicht macht eine starre Anordnung von membranständigen Kalziumkanälen unwahrscheinlich. Tatsächlich konnten wir mit Hilfe von Einzelmolekülmessungen zeigen, dass Kalziumkanäle deutlich mobiler sind, als erwartet (Schneider et al. 2015).
In diesem Forschungsprojekt sind wir an der Bedeutung der lateralen Mobilität von spannungsabhängigen Kalziumkanälen interessiert, die sich neben ihren biophysikalischen Eigenschaften auf die Funktion der Kanäle auswirken und die synaptische Übertragung und Plastizität beeinflussen könnte.
Zum Beispiel legen alternative Spleißvarianten von Kalziumkanälen, die eine unterschiedliche Affinität zu intrazellulären Partnermolekülen und synaptischen Vesikeln aufweisen, eine unterschiedliche Verankerung von Kanälen (und damit Mobilität) innerhalb von Signalkomplexen nahe.
Im Zusammenhang mit der klinischen Manifestation der spinocerebellären Ataxie Typ 6 stand hier bereits eine bestimmte C-terminale Spleißvariante im Fokus der Forschung.
Weiterhin haben wir optogenetische Ansätze entwickelt, um die lokale Kalziumkanalorganisation und deren Mobilität reversibel zu stören und die funktionellen Konsequenzen zu überprüfen.
Durch die Untersuchung der Kalziumkanal-Oberflächendynamik und der unterschiedlichen Expressionsprofile von Kanal-Spleißvarianten wollen wir hier den Einfluss der Kanaldynamik auf die Rechenleistung einzelner Synapsen und ihren Einfluss auf die neuronale Netzwerkaktivität aufdecken.
Publikationen:
Heck J, Parutto P, Ciuraszkiewicz A, Bikbaev A, Freund R, Mitlöhner J, Alonso M, Fejtova A, Holcman D, Heine M (2019)
Transient confinement of CaV2.1 Ca2+-channel splice variants shapes synaptic short-term plasticity,
Neuron 103: 66-79.
Schneider R, Hosy E, Kohl J, Klyueva Y, Choquet D, Thomas U, Voigt A, Heine M (2015)
Mobility of calcium channels in the presynaptic Membrane,
Neuron 86: 672-79.